Aminoàcid anàleg fotoreactiu


Un aminoàcid anàleg fotoreactiu és un tipus d'aminoàcid artificial, anàleg als naturals, que pot ésser incorporat a proteïnes i pèptids amb la principal finalitat de detectar interaccions entre diverses proteïnes.[1][2]
Aquestes interaccions entre proteïnes són de vital importància per als processos cel·lulars (metabolisme, comunicació...) que es desenvolupen a l'interior dels organismes vius.[3] Des de l'era genòmica va sorgir la important necessitat de saber quines són les organitzacions i xarxes proteiques que controlen les funcions cel·lulars, i són molts els estudis que han demostrat que la major part de les proteïnes funcionen com a complexos: interaccionant entre elles -reticulació- i no pas com a unitats individuals i separades.[4][5]
Uns exemples d'aquests aminoàcids fotoreactius són: la fotometionina -amb fórmula molecular C6H11N3O2- que deriva de la metionina (C5H11NO2S), o la fotoleucina (C5H9N3O2) que deriva de la leucina (C6H13NO2).[6]
Per tant, detectar aquestes interaccions i relacions entre les proteïnes serà molt important; no només per la investigació bàsica sinó també pel desenvolupament de tractaments i fàrmacs.[7]
La història i els antecedents
Fa anys que s'utilitzen diversos mètodes per tal de determinar les relacions entre les proteïnes. Aquestes tècniques inclouen mètodes basats en l'afinitat com, per exemple, la immunoprecipitació. Perquè aquesta tècnica es pugui realitzar, les cèl·lules han d'haver experimentat una lisi i això suposa un problema, ja que implica la detecció de molts falsos positius que són produïts per la pèrdua de l'estructura original degut als detergents utilitzats durant el procés de trencament cel·lular, els quals poden modificar les interaccions de les proteïnes o mesclar components.
També s'han utilitzat reticuladors tradicionals amino-reactius com per exemple: el formaldehid o derivats dels NHS-ester per estudiar aquestes interaccions. El problema que el formaldehid presenta és que espontàniament forma polímers en solució i no identifica proteïnes concretes. Els NHS-ester són més específics però només reticulen residus d'aminoàcids concrets situats a unes distàncies determinades.
Més recentment, han aparegut els aminoàcids fotoreactius. El 1986, es va desenvolupar un nou aminoàcid (el p-Benzoil-L-fenilalanina).[8] Aquest aminoàcid anàleg es va poder incorporar a pèptids i va representar un avanç molt important per identificar les relacions entre ells. Tot i això, presentava un problema per falta de versatilitat i és que no podia ésser detectat amb la degradació d'Edman. Més endavant, l'any 1997, es va sintetitzar un altre fotoaminoàcid -el p-4-hidroxibenzoil fenilalanina- que sí que va ésser possible de reconèixer amb la tècnica anteriorment esmentada.[9][10] Finalment, el 2005-2006 es van desenvolupar tres aminoàcids fotoreactius anàlegs d'una gran especificitat de reticulació: la fotoMetionina, la fotoLeucina i la fotoIsoleucina.[1]
Les característiques

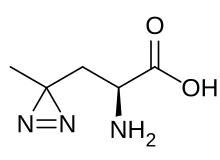
El grup dels fotoaminoàcids permeten la identificació de les interaccions febles entre proteïnes després de la fotoactivació corresponent de les molècules. Per exemple, hi ha interaccions dèbils de proteïnes de membrana que són difícils de detectar mitjançant la immunoprecipitació amb detergents però, en canvi, és possible amb aquests processos de reticulació.[11] Aquest procediment és efectiu a causa de la gran similitud que hi ha entre els fotoaminoàcids i els seus anàlegs naturals, com per exemple: la fotoMetionina amb la Metionina i la fotoLeucina amb la Leucina. La diferència que hi ha entre els aminoàcids artificials i els naturals és que els primers contenen un anell de "diazirine" que és fotoactivable amb la llum ultraviolada (UV).[12] Un cop activats, es forma un carbè radioactiu intermedi que unirà de manera irreversible les proteïnes portadores de fotoreactius amb qualsevol cadena d'aminoàcids amb una distància d'unió molt curta, i permetrà a l'investigador visualitzar quines interaccions s'han produït.[13]
Tot i aquesta petita diferència, la similitud entre elles és tan precisa que fa que les estudiades puguin “escapar” del reconeixement dels aaRS, permetent així la seva incorporació a les proteïnes de membrana entre d'altres. Habitualment, la incorporació d'aminoàcids no naturals en les proteïnes necessita la modificació de la maquinària traductora.[14] En aquest cas, no ha estat modificada però la incorporació és factible per aquesta mateixa similitud.
Hi ha dos paràmetres importants a l'hora de treballar amb fotoaminoàcids: el primer és la freqüència d'incorporació dels fotoaminoàcids que experimentalment s'ha deduït, que es troba a un 0,7% en fotoMetionina i s'assumeixen unes xifres bastant semblants en la fotoleucina perquè l'activitat és molt similar. Això suposa la substitució de 3-4 Metionines o Leucines en una proteïna de 500 aminoàcids aproximadament, el que és suficient perquè els resultats siguin observables un cop feta la fotoactivació. En proteïnes més petites, però, el nombre d'aminoàcids substituïts seria molt inferior; fet pel qual s'hauria d'incrementar aquest percentatge per tal que la pràctica resultés factible.
L'altre paràmetre que cal considerar és l'especificitat en la substitució de Metionines i Leucines pels seus anàlegs fotoreactius, és a dir, la competència existent entre les Metionines i Leucines naturals de les no naturals en la traducció de les proteïnes, pel que la fotoMetionina i la fotoLeucina substituirien en les proteïnes a la Metionina natural en el primer cas i a la Leucina natural en el segon. Cal destacar que també es dona una lleu competència de la Leucina en la incorporació de la fotoMetionina. Per avaluar-ho es va transferir un plasmidi que codificava per una proteïna de la membrana (PGRMC1) i es va observar com la Metionina i la Leucina competien amb la fotoMet o la fotoLeu per la reticulació.[1]
La capacitat de reticulació dels fotoaminoàcids és semblant a la que es podria aconseguir amb estructures de reticulació química com el DSS o el formaldehid, tot i que són encara més específics que aquests, tal com es demostra a l'experiment de reticulació Rpt4. A més, la reticulació amb fotoaminoàcids presenta uns altres avantatges enfront de la fixació química. Un d'aquests és que la incorporació de fotoaminoàcids no interfereix en el reconeixement de les proteïnes pels anticossos un cop aquests són activats, en canvi, no es pot arribar a fer això amb èxit amb unes mostres fixades químicament.[11]
Per últim, cal mencionar també algunes de les característiques de la fotoLeucina i la fotoMetionina, i és que són molècules estables en les condicions bàsiques del laboratori, però cal evitar una exposició prolongada a la llum. A més, són substàncies solubles en solucions aquoses fins a 10 mg/mL i 6 mg/mL respectivament. Cal destacar que si en un experiment s'utilitzen combinades, la seva eficàcia augmenta considerablement.[6]
La incorporació a les proteïnes
Per tal de dur a terme la incorporació dels fotoaminoàcids a determinades proteïnes, primer de tot és necessari preparar un cultiu de fibroblasts en presència de la fotoMetionina i de l'isòtop radioactiu 14C. Les proteïnes incorporaran la fotoMetionina a la qual se li haurà unit l'isòtop. Per comprovar-ho, cal sotmetre les proteïnes marcades a una hidròlisi total i a una separació dels aminoàcids mitjançant una columna d'intercanvi iònic. Així es pot observar que un percentatge ha incorporat el fotoaminoàcid, que un altre l'hauria adquirit però se n'hauria deslliurat a causa del procés d'hidròlisi i, en canvi, un darrer grup no hauria incorporat l'aminoàcid reactiu.[11]
La fotoactivació

Per la fotoactivació dels fotoaminoàcids es necessiten làmpades d'UV que irradiïn rajos d'una longitud d'ona d'entre 320 i 370 nm, tot i que el valor òptim és de 345 nm. Les làmpades que tinguin un alt voltatge seran més efectives i requeriran un temps menor d'exposició que les que en tinguin un de baix. Alguns suggeriments de làmpades són: la Stratalinker 2400 o les de vapor de mercuri, entre d'altres.[6]
La toxicitat
Generalment, els aminoàcids no naturals són tòxics per a les cèl·lules. Per tant, caldria esperar que la fotoMet, la fotoLeu i la fotoIle també ho fossin. Tot i això, en un estudi s'ha demostrat que aquests fotoaminoàcids radioactius no ho són; ni pel que fa a la seva morfologia, que és lleugerament diferent de l'aminoàcid natural, ja que incorporen un anell de diazirine, ni tampoc per les radiacions UV que són necessàries per activar-los. Això es pot corroborar amb un assaig quantitatiu que utilitza la β-galactosa.[15]
Amb aquesta prova es mesura l'activitat bio-sintetitzadora que s'expressa amb l'absència o amb la presència d'aquests fotoaminoàcids. Amb aquesta s'ha vist que l'addició de la fotoMetionina o qualsevol altre fotoaminoàcid no afecta l'activitat enzimàtica, punt clau per la correcta utilització d'aquestes molècules.
L'especificitat de reticulació
La partícula reguladora 19S proteasoma és un complex de 17 subunitats de proteïnes que es va utilitzar per demostrar l'especificitat de la vinculació entre els fotoaminoàcids. Per a fer-ho, es va estudiar, mitjançant anticossos, la reticulació d'aquests amb dues de les subunitats del proteasoma esmentat anteriorment: la Rpt4 (S10B) i la Rpt1 (S7). Després de la reticulació, a la Rpt4 s'hi van detectar tres bandes reticulades amb diferents pesos moleculars: 120, 140 i 145 KDa. Aquestes són la conseqüència de la interacció d'aquesta subunitat amb altres tres. En canvi, al Rpt1 no s'hi va trobar cap banda reticulada, tret d'una a 115KDa detectada abans de la irradiació que representava la reactivitat creuada amb l'anticòs. Així doncs, malgrat la gran similitud entre les proteïnes, no es van detectar interaccions comunes, fet que demostra l'alta especificitat del procediment.[1]
La utilització
Diferents estudis han demostrat l'eficàcia dels fotoreactius i per tant, aquests ja són considerats com un bon mètode per identificar les interaccions proteïna-proteïna a les cèl·lules.
Cal destacar que aquesta tècnica, en la qual s'utilitzen fotoreticulants, és l'única capaç de detectar les interaccions anteriorment esmentades quan no hi ha dades cristal·logràfiques, fet bastant habitual quan es tracta de proteïnes de membrana. Un exemple és l'estudi que ha pogut demostrar una interacció entre la proteïna PGRMC1 i el gen Insig-1 que no s'havia detectat anteriorment.[16]
Altres funcions
En les leucèmies s'ha descobert que hi ha una sobre-expressió del gen que es codifica per la proteïna WT1.[17] S'han realitzat diferents assajos clínics que alteren seqüències de WT1 per utilitzar-les com a vacunes. Així doncs, es presenta una estratègia per a estudiar les interaccions entre la proteïna WT1 i els MHC, mitjançant la incorporació d'aminoàcids no naturals i fotoreactius a la seqüència de pèptids del WT1. Alguns d'aquests pèptids poden estabilitzar millor les molècules del MHC que les seqüències d'aminoàcids natius i per tant, aquestes són capaces de provocar respostes de les cèl·lules T específiques. Per tant, els aminoàcids fotoreactius, a més d'aportar -tal com s'ha dit abans- informació bioquímica, ja que podem saber quines i com són les interaccions entre proteïnes, també són un plus en la resposta immunològica.
Els aminoàcids fotoreactius també proporcionen informació cinètica, ja que amb l'estudi esmentat anteriorment, es pot veure que les interaccions entre els pèptids i els MHC són de durada molt curta i per tant, el complex s'elimina molt ràpidament.[18]
Referències
- ↑ 1,0 1,1 1,2 1,3 Suchanek, Monika; Radzikowska, Anna; Thiele, Christoph «Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells» (en angès). Nature Methods, 2005, pàg. 261-268.
- ↑ van Hest JCM, Kiick KL, Tirrell DA: Efficient incorporation of unsaturated methionine analogues into proteins in vivo. J Am Chem Soc 2000, 122:1282-1288.
- ↑ «Artificial, Photactivatable Amino Acids for Crosslinking Proteins in Living Cells». Arxivat de l'original el 2013-10-20. [Consulta: 19 octubre 2013]. Article publicat per Max-Planck-Innovation. Apr;2(4):261-7(2005).
- ↑ «Systematic identification of protein complexes in Saccharomyces cerevisiae by mass spectrometry». Nature p. 180−183. (2002)
- ↑ «Functional organization of the yeast proteome by systematic analysis of protein complexes». Nature p. 141−147.
- ↑ 6,0 6,1 6,2 «L-Photo-Leucine, L-Photo-Methionine» (en anglès). Pierce Biotechnology. Thermo Scientific, 1984.
- ↑ Gadek, T.R. Strategies and methods in the identification of antagonists of protein-protein interactions. Biotechniques (Suppl.) 34, 21−24 (2003)
- ↑ J C Kauer, S Erickson-Viitanen, H R Wolfe Jr and W F DeGrado. p-Benzoyl-L-phenylalanine, a new photoreactive amino acid. Photolabeling of calmodulin with a synthetic calmodulin-binding peptide. August 15, 1986 The Journal of Biological Chemistry, 261, 10695-10700.
- ↑ Abdul H. Fauq, Chewki Ziani-Cherif and Elliott Richelson. Abdul H. Fauq, Chewki Ziani-Cherif and Elliott Richelson. Tetrahedron: Asymmetry 9 (1998) 2333–2338.
- ↑ «Enllaç».Wilson CJ, Husain SS, Stimson ER, Dangott LJ, Miller KW, Maggio JE.p-(4-Hydroxybenzoyl)phenylalanine: A Photoreactive Amino Acid Analog Amenable to Radioiodination for Elucidation of Peptide−Protein Interaction Application to Substance P Receptor. Biochemistry. 1997 Apr 15;36(15):4542-51.
- ↑ 11,0 11,1 11,2 Bomgarden, Ryan «Studying Protein Interactions in Living Cells». Genetic Engineering & Biotechnology News, 28, 7, 2008.
- ↑ «Photo-Activatable Amino Acids - Patent application».Christoph Thiele and Monika Suchanek, Photo-Activatable Amino Acids.
- ↑ «Enllaç». Wolfgang Burgermeister, Michael Nassalb, Theodor Wielandb, Ernst J.M Helmreicha, Biochimica et Biophysica Acta (BBA) - Biomembranes, A carbene-generating photoaffinity probe for beta-adrenergic receptors.
- ↑ «Enllaç». J. D. Bain, Edward S. Diala, Charles G. Glabe, Thomas A. Dix, A. Richard Chamberlin, American Chemical Society, Biosynthetic site-specific incorporation of a non-natural amino acid into a polypeptide.
- ↑ «Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells».. Page 2. 2005 Nature Publishing Group
- ↑ Thermo Scientific. Pierce™ Photoreactive Amino Acids
- ↑ «Aberrant overexpression of the Wilms tumor gene (WT1) ... [Blood. 1997] - PubMed - NCBI». Inoue K, Ogawa H, Sonoda Y, Kimura T, Sakabe H, Oka Y, Miyake S, Tamaki H, Oji Y, Yamagami T, Tatekawa T, Soma T, Kishimoto T, Sugiyama H.Department of Medicine III, Osaka University Medical School, Japan.
- ↑ «Non-Natural and Photo-Reactive Amino Acids as Biochemical Probes of Immune Function». Gómez-Nuñez M, Haro KJ, Dao T, Chau D, Won A, et al. (2008). PLoS ONE 3(12): e3938. doi:10.1371/journal.pone.0003938
