Dioxolane
| Dioxolane | |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Dioxolane | ||
| Synonymes | 1,3-dioxolane | ||
| No CAS | 646-06-0 | ||
| No ECHA | 100.010.422 | ||
| No CE | 211-463-5 | ||
| No RTECS | JH6760000 | ||
| PubChem | 12586 | ||
| ChEBI | 87597 | ||
| SMILES | O1COCC1 PubChem, vue 3D | ||
| InChI | InChI : vue 3D InChI=1S/C3H6O2/c1-2-4-5-3-1/h1-3H2 InChIKey : SNQXJPARXFUULZ-UHFFFAOYSA-N | ||
| Apparence | liquide incolore[1] | ||
| Propriétés chimiques | |||
| Formule | C3H6O2 [Isomères] | ||
| Masse molaire[2] | 74,078 5 ± 0,003 4 g/mol C 48,64 %, H 8,16 %, O 43,2 %, | ||
| Propriétés physiques | |||
| T° fusion | −26 °C[1] | ||
| T° ébullition | 74 °C[1] | ||
| Solubilité | miscible avec l'eau[1],[3] | ||
| Paramètre de solubilité δ | 21,8 J1/2·cm-3/2 (25 °C)[4] | ||
| Masse volumique | 1,06 g·cm-3 à 20 °C[1] | ||
| T° d'auto-inflammation | 245 °C[1] | ||
| Point d’éclair | −5 °C[1] | ||
| Limites d’explosivité dans l’air | de 2,3 à 30,5 vol.%[1] | ||
| Pression de vapeur saturante |
| ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,401 à 20 °C[5] | ||
| Précautions | |||
| SGH[1],[5] | |||
  H225 : Liquide et vapeurs très inflammables H319 : Provoque une sévère irritation des yeux P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P303+P361+P353 : En cas de contact avec la peau (ou les cheveux) : enlever immédiatement les vêtements contaminés. Rincer la peau à l’eau/se doucher. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P337+P313 : Si l’irritation oculaire persiste : consulter un médecin. P403+P233 : Stocker dans un endroit bien ventilé. Maintenir le récipient fermé de manière étanche. P501 : Éliminer le contenu/récipient dans … | |||
| SIMDUT[6] | |||
Produit non classé La classification de ce produit n'a pas encore été validée par le Service du répertoire toxicologique Divulgation à 1,0% selon la liste de divulgation des ingrédients | |||
| Transport[1] | |||
Numéro ONU : 1166 : DIOXOLANNE Classe : 3 Étiquette :  3 : Liquides inflammables Emballage : Groupe d'emballage II : matières moyennement dangereuses ; | |||
| Écotoxicologie | |||
| DL50 | 3000 mg·kg−1 (rat, oral)[1] 9040 mg·kg−1 (lapin, s.c.)[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Les dioxolanes sont une famille de composés organiques hétérocyliques, comportant un cycle de 5 atomes dont deux atomes d'oxygène. Les composés parents sont le 1,2-dioxolane de numéro CAS #4362-13-4 et le 1,3-dioxolane, CAS #646-06-0 .
Le 1,3-dioxolane ne possédant pas deux atomes d'oxygène vicinaux (voisins ou consécutifs), n'est donc pas un peroxyde et à ce titre est stable, contrairement au 1,2-dioxolane, un peroxyde instable.
Le 1,3-dioxolane est utilisé comme solvant et comme un comonomère dans les polyacétals.
Certains produits naturels comme le sporol et son isomère le néosporol présentent, dans leur struc- ture, des cycles 1,3-dioxolane.
Synthèse
Le 1,3-dioxolane peut être obtenu par une réaction entre l'éthylène glycol (alias éthane-1,2-diol) et le formaldéhyde (méthanal)[7] :
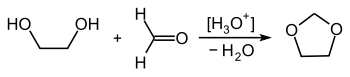
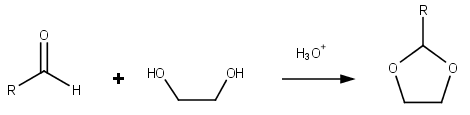
D'une manière générale, les dioxolanes sont synthétisés de la même manière en particulier quand ils sont formés pour protéger une fonction oxo sous forme d'acétal cyclique. Ainsi l'éthylène glycol permet l'acétalisation des aldéhydes et la cétalisation des cétones[8] :
Groupe protecteur
Certains composés organiques contenant des groupes carbonyles ont besoin parfois que ces groupes soient protégés pour éviter qu'ils ne réagissent lors de réactions destinées à modifier d'autres fonction- nalités de ces composés. À cet effet, plusieurs approches de protection et de déprotection[9] en particu- lier via des dioxolanes[10] sont connues. Par exemple, la réduction du 4-oxocyclohexanecarboxylate de méthyle avec l'aluminohydrure de lithium (LiAlH4) génère le 4-hydroxyméthylcyclohexanol. En proté- geant la cétone par un cétal, il est possible de ne réduire que la fonction ester. Ce cétal est produit par la réaction de la molécule de départ avec l'éthylène glycol, catalysée par un acide. Puis la réduction est effectuée et finalement par déprotection par hydrolyse, la 4-hydroxyméthylcyclohexanone est obtenue :
Le Tétrakis(3,5-bis(trifluorométhyl)phényl)borate de sodium ([Na+(BArF4)−], alias "BARF") peut être aussi utilisé pour déprotéger des carbonyles sous forme de dioxolane[9],[10]. Par exemple, la dépro- tection du 2-phényl-1,3-dioxolane en benzaldéhyde peut être faite dans l'eau en cinq minutes à 30 °C[11] :
- PhCH(OCH2)2 + H2O PhCHO + HOCH2CH2OH
Notes et références
- ↑ a b c d e f g h i j k l et m Entrée « 1,3-Dioxolane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 mai 2016 (JavaScript nécessaire)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (de) « 1,3-Dioxolan », sur Römpp Online, Georg Thieme Verlag (consulté le )
- ↑ (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- ↑ a et b Fiche Sigma-Aldrich du composé 1,3-Dioxolane, anhydrous, contains ~75 ppm BHT as inhibitor, 99.8%, consultée le 14 février 2013. + (pdf) fiche SDS.
- ↑ « Dioxolane-1,3 » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Karl-Heinz Lautenschläger, Werner Schröter, Andrea Wanninger, Taschenbuch der Chemie, Harri Deutsch Verlag, 2005, p. 451. (ISBN 978-3-8171-1760-4), page sur Googlebook.
- ↑ R. A. Daignault, E. L. Eliel, 2-Cyclohexyloxyethanol (involves acetalisation of cyclohexanone), Organic Syntheses, 1973, coll. vol. 5, p. 303.
- ↑ a et b Theodora W. Greene, Peter G. M. Wuts, Dimethyl acetals, Greene's Protective Groups in Organic Synthesis (Archive), 3e ed., Wiley-Interscience, 1999, pp. 297–304, 724–727. (ISBN 9780471160199).
- ↑ a et b Theodora W. Greene, Peter G. M. Wuts, 1,3-Dioxanes, 1,3-Dioxolanes, Greene's Protective Groups in Organic Synthesis (Archive), 3e ed., Wiley-Interscience, 1999, pp. 308–322, 724–727. (ISBN 9780471160199).
- ↑ Chih-Ching Chang, Bei-Sih Liao, Shiuh-Tzung Liu, Deprotection of Acetals and Ketals in a Colloidal Suspension Generated by Sodium Tetrakis(3,5-trifluoromethylphenyl)borate in Water, Synlett., 2007, vol. 2007(2), pp. 283–287. DOI 10.1055/s-2007-968009.
 Portail de la chimie
Portail de la chimie


![{\displaystyle {\ce {->[{\ce {NaBArF4}}][{\text{30 °C / 5 min}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/458057116983400d5e912c7f1738541bd48ec876)










