Paire de Lewis

Cet article est une ébauche concernant la chimie.
Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
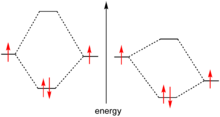
Une paire de Lewis (ou doublet électronique) est une paire d'électrons ayant des spins opposés et occupant une même orbitale atomique.
La paire d'électrons peut constituer soit une liaison covalente soit une paire non-liante, localisée sur une orbitale moléculaire principalement non liante (c'est-à-dire n'influant pas sur la stabilité de l'objet moléculaire[1]), ou son équivalent dans le solide (doublet non engagé). Les paires d'électrons de Lewis jouent un rôle fondamental dans le déroulement de certains processus réactionnels comme les réactions de Grignard, ainsi que dans les propriétés mécaniques de certains matériaux.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lewis pair » (voir la liste des auteurs).
- ↑ Contrairement à une orbitale liante, stabilisante, ou antiliante, déstabilisante.
Voir aussi
- Acide de Lewis
- Base de Lewis
- Configuration électronique
- Électron célibataire
- Nucléophile
v · m | |
|---|---|
| Remplissage des orbitales atomiques | |
| Appariement des électrons |
|
| Position des électrons | |
| Couche de valence | |
 Portail de la chimie
Portail de la chimie











