Disulfidna veza
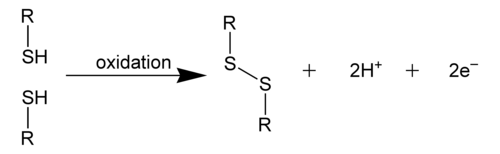
Disulfidna veza je kovalentna veza, obično nastaje spajanjem dve tiolne grupe.[1] Ovaj link se takođe naziva SS-veza ili disulfidni most. Ukupna povezanost je dakle R-S-S-R. Ova terminologija je u širokoj upotrebi u biohemiji. Nekad se ova veza nazivala persulfid, po analogiji sa kongenernim peroksidom (R-O-O-R), ali je ta terminologija nezastupljena.
Osobine
Disulfidna veza je jaka. Njena tipična energija disocijacije veze je 60 kcal/mol. Ona je oko 40% slabija od C-C i C-H veza, i stoga se disulfidna veza često naziva "slabim linkom" u mnogim molekulima. Osim toga, odražavajući polarizabilnost dvovalentnig sumpora, S-S veza je podložna cijepanju polarnim reagensima elektrofilima a posebno nukleofilima.[2]
- RS-SR + Nu- → RS-Nu + RS-
Disulfidna veza je oko 2.05 Å dugačka, što je 0.5 Å duže od C-C veze. Rotacija oko S-S ose ima nisku barijeru. Disulfidi pokazuju izrazitu sklonost za diedralne uglove koji se približavaju uglu od 90°. Kada je ugao blizo 0° ili 180°, disulfid je znatno bolji oksidacioni agens.
Disulfidi sa dve iste R grupe su simetrični. Primeri takvih jedinjenja su difenil disulfid i dimetil disulfid. Asimetrični disulfidi imaju dve različite R grupe.[3]
Iako hidrogenacija disulfida obično nije praktična, konstanta ravnoteže ove reakcije može da služi kao mera standardnog redoks potencijala disulfida:
- RSSR + H2 → 2 RSH
Ova vrednost je oko -250 mV (pH = 7). U poređenju s tim, standardni redukcini potencijal ferodoksina ja oko -430 mV.
Reference
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Cremlyn, R. J. W. (1996). An introduction to organosulfur chemistry. New York: Wiley. ISBN 978-0-471-95512-2.
- ^ Sevier, C. S. & Kaiser, C. A. (2002). „Formation and transfer of disulphide bonds in living cells”. Nature Reviews Molecular and Cellular Biology. 3 (11): 836—847. PMID 12415301. doi:10.1038/nrm954.
Literatura
- Sela M, Lifson S (1959). „The reformation of disulfide bridges in proteins”. Biochim Biophys Acta. 36 (2): 471—8. PMID 14444674. doi:10.1016/0006-3002(59)90188-X.
- Stark GR.; Stern, K; Atala, A; Yoo, J (1977). „Cleavage at cysteine after cyanylation”. Methods Enzymol. 47: 129—32. PMID 927170. doi:10.1016/j.ymeth.2008.09.005.
- Thornton JM. (1981). „Disulphide bridges in globular proteins”. J Mol Biol. 151 (2): 261—87. PMID 7338898. doi:10.1016/0022-2836(81)90515-5.
- Thannhauser TW, Konishi Y, Scheraga HA (1984). „Sensitive quantitative analysis of disulfide bonds in polypeptides and proteins”. Anal Biochem. 138 (1): 181—8. PMID 6547275. doi:10.1016/0003-2697(84)90786-3.
- Wu J, Watson JT (1998). „Optimization of the cleavage reaction for cyanylated cysteinyl proteins for efficient and simplified mass mapping”. Anal Biochem. 258 (2): 268—76. PMID 9570840. doi:10.1006/abio.1998.2596.
- Futami J, Tada H, Seno M, Ishikami S, Yamada H (2000). „Stabilization of human RNase 1 by introduction of a disulfide bond between residues 4 and 118”. J Biochem. 128 (2): 245—50. PMID 10920260.
- Wittenberg, G, Danon, A (2008). „Disulfide bond formation in chloroplasts: Formation of disulfide bonds in signaling chloroplast proteins”. Plant Science. 175 (4): 459—466. doi:10.1016/j.plantsci.2008.05.011. CS1 одржавање: Вишеструка имена: списак аутора (веза)
- Kadokura, Hiroshi; Katzen, Federico; Beckwith, Jon (2003). „Protein Disulfide Bond Formation in Prokaryotes”. Annual Review of Biochemistry. 72: 111. PMID 12524212. doi:10.1146/annurev.biochem.72.121801.161459.
- Tu, B. P.; Weissman, JS (2004). „Oxidative protein folding in eukaryotes: mechanisms and consequences”. The Journal of Cell Biology. 164 (3): 341. PMC 2172237
 . PMID 14757749. doi:10.1083/jcb.200311055.
. PMID 14757749. doi:10.1083/jcb.200311055. - Ellgaard, Lars; Ruddock, Lloyd W. (2005). „The human protein disulphide isomerase family: substrate interactions and functional properties”. EMBO reports. 6 (1): 28. PMC 1299221
 . PMID 15643448. doi:10.1038/sj.embor.7400311.
. PMID 15643448. doi:10.1038/sj.embor.7400311. - Cremlyn, R. J. W. (1996). An introduction to organosulfur chemistry. New York: Wiley.
Spoljašnje veze
- Sinteza disulfida
- Disulfidne veze i kosa
- p
- r
- u
aminokiseline
| Serin/ Treonin | |
|---|---|
| Tirozin | Fosforilacija · Sulfacija · Vezivanje za porfirinski prsten · vezivanje flavina · formiranje p-hidroksibenziliden-imidazolona · formiranje Lizin tirozil kinona (LTQ) · formiranje topakinona (TPQ) |
| Cistein | Disulfidna veza · Palmitoilacija · Prenilacija |
| Aspartat | Formiranje sukcinimida |
| Glutamat | |
| Asparagin | |
| Glutamin | |
| Lizin | Metilacija · Acetilacija · Acilacija · Hidroksilacija · Ubikvitinacija · Sumoilacija · Dezmozin · ADP-ribozilacija · Deaminacija i oksidativna deaminacija do aldehida · O-glikozilacija · formiranje Imina · Glikacija · Karbamilacija |
| Arginin | |
| Prolin | |
| Histidin | Formiranje diftamida |









