Baryum klorür
 | |
 | |
Diğer adlar | |
| Tanımlayıcılar | |
|---|---|
| |
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.704 |
| EC Numarası |
|
PubChem CID |
|
| RTECS numarası |
|
| UNII |
|
| UN numarası | 1564 |
CompTox Bilgi Panosu (EPA) |
|
InChI
| |
SMILES
| |
| Özellikler | |
| Molekül formülü | BaCl2 |
| Molekül kütlesi | 208.23 g/mol (susuz) 244.26 g/mol (dihidrat) |
| Görünüm | Beyaz katı |
| Yoğunluk | 3.856 g/cm3 (susuz) 3.0979 g/cm3 (dihidrat) |
| Erime noktası | 962 °C (960 °C, dihidrat) |
| Kaynama noktası | 1560 |
| Çözünürlük (su içinde) | 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) |
| Çözünürlük | metanol'de çözünür, etanol, etil asetatta çözünmez[2] |
| -72.6·10−6 cm3/mol | |
| Yapı | |
| PbCl2-tipi ortorombik (susuz) monoklinik (dihidrat) | |
| Termokimya | |
Standart molar entropi (S⦵298) | 123.9 J/(k mol) |
Standart formasyon entalpisi (ΔfH⦵298) | −858.56 kJ/mol |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Son derece zehirli, aşındırıcı |
| GHS etiketleme sistemi: | |
| Piktogramlar |  |
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H301, H302, H332 |
| Önlem ifadeleri | P261, P264, P270, P271, P301+P310, P304+P312, P304+P340, P312, P321, P330, P405, P501 |
| NFPA 704 (yangın karosu) |  3 0 0 |
| Parlama noktası | Parlayıcı değil |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz) | 78 mg/kg (sıçan, oral) 50 mg/kg (gine domuzu, oral)[4] |
LDLo (yayınlanan en düşük) | 112 mg Ba/kg (tavşan, oral) 59 mg Ba/kg (köpek, oral) 46 mg Ba/kg (fare, oral)[4] |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 0.5 mg/m3[3] |
| REL (tavsiye edilen) | TWA 0.5 mg/m3[3] |
| IDLH (anında tehlike) | 50 mg/m3[3] |
| Güvenlik bilgi formu (SDS) | NIH BaCl |
| Benzeyen bileşikler | |
Diğer anyonlar | Baryum florür Baryum bromür Baryum iyodür |
Diğer katyonlar | Berilyum klorür Magnezyum klorür Kalsiyum klorür Stronsiyum klorür Radyum klorür Kurşun klorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları | |
Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.
Laboratuvarda ve sanayide kullanımı sınırlıdır.[5]
Hazırlık
Endüstriyel ölçekte, baritten (baryum sülfat ) iki aşamalı işlemle hazırlanır:[6]
Bu ilk adım yüksek sıcaklıklar gerektirir.
İkinci adım, baryum sülfür ve hidrojen klorür arasında bir reaksiyon gerektirir:
- BaS + 2 HCl → BaCl
2 + H
2S
veya baryum sülfür ile kalsiyum klorür arasında reaksiyon gerektirir:
- BaS + CaCl
2 → CaS + BaCl
2[7]
HCl yerine klor kullanılabilir.[5] Baryum klorür su ile karışımdan ekstrakte edilir. Baryum klorürün su çözeltilerinden dihidratı (BaCl
2·2H2O) renksiz kristaller halinde kristalleştirilebilir.[7]
Baryum klorür prensip olarak baryum hidroksit veya baryum karbonatın hidrojen klorür ile reaksiyonuyla hazırlanabilir. Bu bazik tuzlar hidroklorik asitle reaksiyona girerek hidratlı baryum klorür verir.
- Ba(OH)
2 + 2 HCl → BaCl
2 + 2 H
2O - BaCO
3 + 2 HCl → BaCl
2 + H
2O + CO
2
Yapısı ve özellikleri
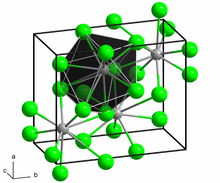
BaCl2 iki biçimde kristalleşir. Birinde kübik florür (CaF2) yapılı diğerinde ortorombik kotunnit (PbCl2) yapılıdır. Her iki polimorfda, altıdan büyük koordinasyon sayıları için büyük Ba2+ iyon tercihini barındırır.[8] Ba2+ 'nin koordinasyonu, florür yapısında[9] 8 ve kotunit yapısında 9'dur.[10] Kotunit-yapı BaCl2, 7-10 GPa basınçlarına maruz kaldığında üçüncü bir yapı olan monoklinik post-kotunnit faza dönüşür. Ba2+'nin koordinasyon sayısı 9'dan 10'a çıkar.[11]
Sulu bir eriyikte BaCl2 basit bir tuz olarak davranır ve suda 1:2 elektrolittir ve çözeltisi nötr pH gösterir.
Çözeltileri, kalın beyaz baryum sülfat çökeltisi oluşturmak için sülfat iyonu ile reaksiyona girer.
- BaCl
2 + Na
2SO
4 → 2 NaCl + BaSO
4
Bu çökeltme reaksiyonu, elektroliz için besleme tuzlu suyundaki sülfat konsantrasyonunu kontrol etmek amacıyla klor-alkali tesislerinde kullanılır.
Oksalat benzer bir reaksiyonu etkiler:
- BaCl
2 + Na
2C
2O
4 → 2 NaCl + BaC
2O
4
Sodyum hidroksit ile karıştırıldığında suda orta derecede çözünen baryum hidroksit verir.
- BaCl
2 + 2 NaOH → 2 NaCl + Ba(OH)
2
BaCl
2·2H2O, oda sıcaklığında havada kararlıdır ancak 55 °C (131 °F) üzerinde kristalizasyon suyunu kaybederek BaCl
2·H2O haline gelir ve 121 °C (250 °F) üzerinde susuz hale gelir.[7]
BaCl
2·H2O, dihidratın metanol ile çalkalanmasıyla oluşturulabilir.[12]
BaCl
2, alkali metal klorürlerle kolayca ötektik oluşturur.
- Ba2+ + SO42− → BaSO4
Okzalat benzer bir reaksiyonu etkiler:
- Ba2+ + C2O2-4 → BaC2O4
Sodyum hidroksit ile karıştırıldığında suda orta derecede çözünen dihidroksit verir.
Kullanımları
Ucuz olmasına rağmen baryum klorürün laboratuvarda ve endüstride sınırlı uygulaması vardır.
Sanayide, baryum klorür esasen kostik klor tesislerinde tuzlu su çözeltisinin saflaştırılmasında ve ayrıca ısıl işlem tuzlarının imalatında, çeliğin[13] sertleştirilmesinde kullanılır.
Ayrıca Lithol red ve Red Lake C gibi kırmızı pigmentleri yapmak için kullanılır.
Zehirliliği kullanımını sınırlar.
Zehirlilik
Baryum klorür, diğer suda çözünür baryum tuzları ile birlikte oldukça toksiktir.[14]
Gözleri ve cildi tahriş ederek kızarıklık ve ağrıya neden olur. Böbreklere zarar verir.
Bir insan için ölümcül baryum klorür dozunun yaklaşık 0,8-0,9 g olduğu rapor edilmiştir.
Akut baryum klorür zehirlenmesinin sistemik etkileri arasında karın ağrısı, ishal, bulantı, kusma, kardiyak aritmi, kas felci ve ölüm vardır.
Ba2+ iyonları, K+
iyonlarıyla rekabet ederek kas liflerinin elektriksel olarak uyarılamaz olmasına neden olur, dolayısıyla vücutta halsizlik ve felce neden olur.[12] Sodyum sülfat ve magnezyum sülfat potansiyel panzehirlerdir çünkü suda çözünmedikleri için nispeten zehirsiz baryum sülfat BaSO4 oluştururlar.
Baryum klorür insanlar için kanserojen olarak sınıflandırılmamıştır.[12]
Kaynakça
- ^ Chemical Recreations: A Series of Amusing and Instructive Experiments, which May be Performed with Ease, Safety, Success, and Economy ; to which is Added, the Romance of Chemistry : An Inquiry into the Fallacies of the Prevailing Theory of Chemistry : With a New Theory and a New Nomenclature. R. Griffin & Company. 1834. 28 Temmuz 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2021.
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0045". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Barium (soluble compounds, as Ba)". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH). Arşivlenmesi gereken bağlantıya sahip kaynak şablonu içeren maddeler (link)
- ^ a b "Barium and Barium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2007. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- ^ a b c Kaynak hatası: Geçersiz
<ref>etiketi;sciencedirectisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. 0-19-855370-6
- ^ Haase (1978). "Hydratstufen und Kristallstrukturen von Bariumchlorid". Zeitschrift für anorganische und allgemeine Chemie. 441: 181-195. doi:10.1002/zaac.19784410120.
- ^ Brackett (1963). "The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide". The Journal of Physical Chemistry A. 67 (10): 2132. doi:10.1021/j100804a038.
- ^ Léger (1995). "The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure". Journal of Applied Crystallography. 28 (4): 416. doi:10.1107/S0021889895001580.
- ^ a b c Kaynak hatası: Geçersiz
<ref>etiketi;pubchemisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). "Barium and Barium Compounds". Ullman, Franz (Ed.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960.
Dış bağlantılar
- Uluslararası Kimyasal Güvenlik Kartı 0614 28 Temmuz 2021 tarihinde Wayback Machine sitesinde arşivlendi. . (susuz)
- Uluslararası Kimyasal Güvenlik Kartı 0615 28 Temmuz 2021 tarihinde Wayback Machine sitesinde arşivlendi. . (dihidrat)
- Baryum klorürün endüstride kullanımı .
- ChemSub Çevrimiçi: Baryum klorür 12 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi. .













