Fluoruro di tionile
| Fluoruro di tionile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| difluoro(osso)-λ4-solfano | |
| Nomi alternativi | |
| difluoruro di tionile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F2OS |
| Aspetto | gas incolore |
| Numero CAS | 7783-42-8 |
| Numero EINECS | 231-997-2 |
| PubChem | 24548 |
| SMILES | O=S(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,780 (-100 °C)[1] |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | −129,5 °C (144 K)[2] |
| Temperatura di ebollizione | −43,8 °C (229 K)[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  | |
| Frasi H | 300 - 310 - 330 - 314 [3] |
| Modifica dati su Wikidata · Manuale | |
Il fluoruro di tionile o difluoruro di tionile è il composto inorganico con formula SOF2. In condizioni normali è un gas incolore di odore soffocante.[1] In questo composto lo zolfo ha stato di ossidazione +4.
Struttura
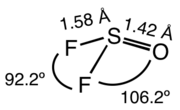
SOF2 è un composto molecolare, gassoso a temperatura ambiente. La forma della molecola è quella di una di piramide distorta, con simmetria Cs.[4] Le distanze S-O e S-F sono rispettivamente 142,0 pm e 158,3 pm; gli angoli O-S-F e F-S-F sono rispettivamente 106,2° and 92,8°. I corrispondenti alogenuri SOCl2 e SOBr2 hanno strutture simili, ma sono liquidi a temperatura ambiente. Sono noti anche alogenuri misti, tipo SOClF e SOBrF.[2]
Sintesi
Il fluoruro di tionile fu ottenuto per la prima volta nel 1896 da Maurice Meslans (1862-1938), allievo di Henri Moissan, trattando cloruro di tionile con fluoruro di zinco.[5] In seguito furono usate altre fonti di ioni fluoruro, come il fluoruro di idrogeno[1] o il trifluoruro di antimonio:[2][6]
Alternativamente si può fluorurare il diossido di zolfo con pentafluoruro di fosforo:[2]
Reattività
SOF2 è un gas termicamente stabile fino al calor rosso. Al di sotto di 125 ºC non attacca né il vetro né i metalli ferro, nichel, cobalto, mercurio, magnesio alluminio e zinco.[1] A contatto con acqua si idrolizza formando diossido di zolfo e acido fluoridrico:[2]
Reagisce con il fluoro per formare tetrafluoruro di tionile:[2]
Chimicamente SOF2 si comporta come una base di Lewis debole, tramite il doppietto non condiviso sull'ossigeno, e anche come acido di Lewis debole, legandosi tramite lo zolfo; in questo senso reagisce con ioni F− formando l'anione [O=SF3]–.[2]
Note
Bibliografia
- (EN) H. S. Booth e F. C. Mericola, The Fluorination of Thionyl Chloride, in J. Am. Chem. Soc., vol. 62, n. 3, 1940, pp. 640-642, DOI:10.1021/ja01860a058.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 1, 2ª ed., New York, Academic Press, 1963, ISBN 0323161278.
- GESTIS, Thionyl fluoride, su gestis-en.itrust.de. URL consultato il 17 dicembre 2019. Pagina del fluoruro di tionile nel data base GESTIS.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) W. C. Smith e E. L. Muetterties, Thionyl Fluoride, in Inorg. Synth., vol. 6, 1960, pp. 162-163, DOI:10.1002/9780470132371.ch50.
Voci correlate
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su fluoruro di tionile
Wikimedia Commons contiene immagini o altri file su fluoruro di tionile
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia















